Autores: P. Olbrich (Infectología, UGC Pediatría, coordinador), M.E. Jiménez-Mejías (UCEIMP, coordinador), C. Montero (UGC Urgencias Pediátricas), O. Neth (Infectología, UGC Pediatría,), W.A. Goycochea Valdivia (Infectología, UGC Pediatría,), T. Charlo (UCI-P), M. Rivero Gavira (Neurocirugía), M. Moleón (UGC Farmacia), J.A. Lepe (UCEIMP), M. Fajardo (UGC Radiología), J Márquez-Rivas (Neurocirugía).UCG
- Consideraciones generales:
- Las infecciones de los sistemas de derivación de LCR son una de las complicaciones más frecuentes y graves de la cirugía de los shunts.
- Son causa frecuente de ingresos hospitalarios, procedimientos invasivos, estancias hospitalarias prolongadas, secuelas neurológicas y mortalidad.
- En los primeros 24 meses tras la inserción del dispositivo, un 10-45% se ha infectado.
- La cirugía inicial y las revisiones del shunt son los factores de riesgo más relevantes.
- A pesar de su considerable incidencia, existe un alto grado de controversia sobre el manejo óptimo de las infecciones relacionadas con los dispositivos de drenaje de LCR.
- Los estudios realizados presentan diversos problemas metodológicos, lo que impide llegar a conclusiones con un alto grado de evidencia.
- Existe gran discordancia entre los protocolos de actuación entre los diferentes centros hospitalarios.
- Muchas recomendaciones se basan en la “opinión de expertos” debido a la ausencia de evidencia clínica y baja probabilidad de poder realizar ensayos clínicos apropiados para generar datos con mayor grado de evidencia.
- El manejo óptimo busca cumplir los siguientes objetivos:
- Implantar medidas para evitar la infección del shunt.
- Curación y erradicación de la infección (incluye posibles recaídas y reinfecciones).
- Mantener la funcionalidad del sistema del drenaje.
- Realizar actuaciones poco invasivas, con baja morbilidad, mortalidad y coste.
- Existe consenso actual que el manejo óptimo debe ser médico-quirúrgico.
- Clínica. Síntomas muy variables, dependiendo de:
- Edad del paciente.
- Forma de presentación.
- Tipo de malfunción del shunt.
- Gravedad del cuadro.
Entre los síntomas y signos más frecuentes: Fiebre aguda, fiebre prolongada sin focalidad evidente, crisis convulsivas, alteración del nivel de conciencia, cefalea, irritabilidad, visión doble, meningismo (<20%), apneas, signos inflamatorios en la zona del trayecto del catéter, vómitos, dolor abdominal y peritonismo.
- Definición de infección del shunt o del sistema de drenaje:
- Infección comprobada: Clínica compatible + muestra microbiológica positiva (cultivo o/y tinción de Gram de LCR, cultivo de herida/fistula/material de pseudoquiste, ó reacción en cadena de la polimerasa positiva en LCR o del pseudoquiste).
- Infección probable: Clínica compatible y/o alteraciones licuorales compatibles (pleocitosis, consumo de glucosa e hiperproteinorraquía).
- Situaciones de alto grado de sospecha para presentar una infección del shunt:
- Febrícula/fiebre de bajo grado sin focalidad.
- Alteración del nivel de conciencia.
- Dolor abdominal inespecífico.
- Erosión cutánea con exposición del material del shunt (dispositivo visible en cualquier parte del mismo).
- Pseudoquiste abdominal (licuoroma). Aunque el cultivo sea negativo, una vez descartada tabicación peritoneal.
- Hemocultivo positivo en niños con shunt ventrículo-auricular
- Recomendaciones generales en el abordaje diagnóstico de pacientes con ventriculitis o meningitis asociada la atención sanitaria y su nivel de evidencia (GRADE):
| Calidad evidencia | Grado de recomendación | |
| Signos clínicos sugestivos de infección de shunt de LCR: | ||
| – Aparición de cefalea, náuseas, letargia o afectación del nivel de conciencia o relación.
– Febrícula o fiebre sin foco evidente. – Dolor abdominal o signos de peritonitis o distensión abdominal sin otra causa evidente. – Fistula de LCR. – Cambios en la apariencia, o aumento de leucocitos en LCR en pacientes con drenaje externo. |
Fuerte
Débil Fuerte Fuerte Débil |
Moderado
Bajo Moderado Moderado Bajo |
| Datos analíticos | ||
| – La alteración de la citoquímica* aunque sugestivo no es indicativo de infección.
– La normalidad citoquímica del LCR tampoco descarta una infección. |
Débil
Débil |
Moderado Moderado |
| Cultivo de LCR: | ||
| – Es la prueba más importante para establecer la infección.
– Deben ser incubados durante 10-14 días, para poder aislar microorganismos anaerobios. ** – El aislamiento de Staphylococcus aureus o de Candida spp, es indicativo de infección. – Deben obtenerse cultivos del shunt o drenaje retirado en el contexto de una infección. |
Fuerte
Fuerte Fuerte Fuerte |
Alto
Alto Moderado Moderado |
| Otras medidas diagnósticas: | ||
| – La determinación de lactato o de procalcitonina en el LCR puede ser útil.
– La procalcitonina sérica puede ayudar diferenciar entre una pleocitosis secundaria a una intervención/hemorragia o una pleocitosis de causa infecciosa. – Se recomienda la realización de estudios de neuroimagen (TC con contraste ó RM con gadolinio e imágenes de difusión) en pacientes con sospecha de infección de shunt. – Se recomienda la RM con gadolinio con imágenes de difusión. – En pacientes con clínica abdominal se recomienda la realización de ecografía o TAC abdominal con contraste. |
Débil
Débil
Fuerte
Fuerte Fuerte
|
Moderado
Bajo
Moderado
Moderado Moderado |
*recuento celular, consumo de glucosa, o aumento de proteínas
** como p.ej. Cutibacterium acnes
- Consideraciones prácticas:
(1) En situaciones de alto riesgo de infección de shunt, se debe obtener muestra de LCR.
(2) En un paciente con infección comprobada, debe realizarse retirada completa del sistema (generalmente en menos de 48 horas)* e iniciar tratamiento antibiótico empírico (nivel de recomendación fuerte, alto).
(3) En caso de fiebre >24-48 horas en un paciente portador de shunt, sin foco infeccioso evidente se debe valorar obtener una muestra de LCR con la mayor brevedad posible.
(4) En pacientes con sospecha de infección de shunt, la normalidad de marcadores sistémicos habituales de procesos infecciosos (p.ej. PCR, PCT, recuento leucocitario), no descartan una infección del shunt.
*Siempre que las condiciones clínicas, la situación del sistema ventricular, etc, lo permitan.
- Manejo del paciente con sospecha de infección de un dispositivo de LCR (ver también anexos 4-6):
- Historia clínica:
- Anamnesis general completa, buscando descartar otros focos de infección (como por ejemplo ITU, neumonía, etc).
- Anamnesis específica
- Indicación y momento de inserción del dispositivo.
- Tipo de dispositivo.
- Última manipulación/punción/infección del dispositivo (germen y antibiograma).
- Incidencias en heridas quirúrgicas: dehiscencias, fistula de LCR, signos inflamatorios cutáneos.
- Última revisión por parte de neurocirugía.
- Tratamientos antibióticos recibidos.
- Presencia de inmunodeficiencia o tratamientos inmunodepresores
- Exploración física completa presentando especial atención a la exploración neurológica, del sistema derivativo (funcionamiento del shunt: presión, repleción, recorrido catéter) y abdominal.
- Pruebas complementarias:
| Extracción de LCR por punción lumbar (*), reservorio valvular (**) o del drenaje externo (#) | ¡Ojo! Las alteraciones licuorales suelen ser menos intensas que en las meningitis bacterianas comunitarias |
|
Solicitar: Estudio citoquímico de LCR y determinación de niveles de Lactato.
Resultados sugestivos de infección: · LCR turbio, con pleocitosis, de predominio polimorfonuclear, consumo de glucosa (índice glucorraquia/glucemia < 0.45), e hiperproteinorraquia. (##) · Modificación del aspecto y bioquímica del LCR al compararlo con los previos (en derivaciones externalizadas). · Lactato en LCR > 4 mmol/l. · Ocasionalmente LCR “normal” o con escasas alteraciones en situaciones de “alto riesgo” como pseudoquiste abdominal u obstrucciones valvulares “estériles” previas. Es estos casos hay que sospechar infección por Cutibacterium spp. |
|
| Muestras microbiológicas | · LCR: cultivos en medios aerobios y anaerobios, especificando el origen de la muestra (LCR ventricular, derivación externa, fistula), tinción de Gram urgente
· En casos seleccionados de infección probable (principalmente pleocitosis y consumo de glucosa) se debe solicitar PCR multiplex. |
| Hemocultivos | |
| · Cultivos de lesiones cutáneas, escaras relacionadas con el trayecto valvular y puntos de inserción de catéteres ventriculares.
· Cultivo de pseudoquistes (licuoromas) o otras colecciones abdominales. |
|
| Analítica general | Hemograma, estudio de coagulación, bioquímica básica, renal y hepática, proteína C reactiva y procalcitonina($) |
| Pruebas de Imagen | TAC craneal simple (baja irradiación). Radiografía del trayecto valvular. |
| TAC craneal con contraste o RM craneal con gadolinio e imágenes de difusión, en caso de sospecha de colecciones perivalvulares, abscesos, empiemas, etc… | |
| Ecografía abdominal: si sospecha colecciones intra-abdominales secundarias a derivaciones ventrículo-peritoneales: pseudoquistes (licuoromas) o abscesos. | |
| Ecocardiografía si sospecha de infección asociada a derivación ventrículo-atrial o bacteriemia por Staphylococcus aureus. |
(*) Contraindicada en pacientes con shunts permanentes y en los mismos supuestos que en las meningitis comunitarias.
(**) La realizará el neurocirujano.
(#) Con extremas condiciones de asepsia y esterilidad.
(##) normal: £ 32 leucocitos/mm3 (neonato < 1mes de vida), £ 10 leucocitos/mm3 (niño > 1mes de vida), glucorraquia 40-45% de la glucemia concomitante, y proteínas <200mg/dl.
($) La procalcitonina solamente se solicitará en pacientes que acuden a urgencias con fiebre de <24 horas de evolución
- Etiología:
- Tratamiento empírico:
| Etiología | Tratamiento antimicrobiano empírico*,** | |
| Post-neurocirugía | Staphylococcus spp., Cutibacterium acnes, bacilos gramnegativos nosocomiales | Ceftazidima# + Vancomicina |
| Asociadas a catéter de drenaje externo | Staphylococcus spp., bacilos gramnegativos nosocomiales, Cutibacterium acnes | Ceftazidima# + Vancomicina |
| Fistula de LCR | Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Staphylococcus epidermidis, bacilos gramnegativos | Ceftazidima# + Vancomicina |
*Considerar iniciar Meropenem empírico en pacientes colonizados por patógenos BLEE.
** Considerar riesgo/beneficio de Meropenem especialmente en neonatos.
*** En pacientes con schock séptico (según definición disponible en el capitulo “Sepsis en pacientes pediátricos” de la guía PRIOAM) se recomienda empírico de Vancomicina + Meropenem
# En el momento de la publicación de la guía la recomendación en nuestro centro es Ceftazidima+ Vancomicina.
6a. Tratamiento en función del resultado de la tinción de Gram:
| Tinción de Gram | Etiología probable | Tratamiento antimicrobiano empírico |
| Diplococos grampositivos o cocos grampositivos en cadenas | Sreptococcus pneumoniae
Streptococcus spp. |
Cefotaxima o Ceftriaxona* (± Vancomicina**) |
| Cocos grampositivos en racimos | Staphylococcus aureus, Staphylococcus epidermidis | Vancomicina ± Rifampicina |
| Cocobacilos gramnegativos | Haemophilus influenzae | Cefotaxima o Ceftriaxona* |
| Diplococos gramnegativos | Neisseria meningitidis | Cefotaxima o Ceftriaxona* |
| Bacilos gramnegativos | Haemophilus influenzae y otros bacilos gramnegativos. | Cefepima o Ceftazidima o Meropenem# |
| Bacilos grampositivos | Listeria monocytogenes
Cutibacterium acnes |
Ampicilina ± Gentamicina |
| Levaduras | Candida ssp |
* Contraindicada en neonatos. Valorar otras opciones (p. ej. Cefotaxima)
** Baja incidencia de S. pneumoniae resistente a cefotaxima, por lo que se podría evitar su administración.
# Según recomendaciones anteriores (apartado 4).
6b. Tratamiento antibiótico en función del germen y antibiograma (ver también Anexo 1) *,**
| Etiología | Tratamiento dirigido | Tratamiento alternativo | Duración propuesta (días) |
| Streptococcus pneumoniae | |||
| CMI Penicilina | |||
| <0.1mg/L | Penicilina G Na ó ampicilina | Ceftriaxona***/cefotaxima | Mínimo 10 |
| 0.1-1.0mg/L | Ceftriaxona o cefotaxima | Cefepima, meropenem | Mínimo 10-14 |
| >2.0mg/L | Ceftriaxona o cefotaxima | Fluorquinolona**** | 14 |
| CMI Cefotaxima | |||
| > 1.0mg/L | Vancomicina | Fluorquinolona**** | 14 |
| >2.0mg/L | Ceftriaxona o cefotaxima +
Vancomicina+ rifampicina |
Meropenem | 14 |
| Streptococcus agalactiae | |||
| Ampicilina ó penicilina GNa ± aminoglucósido | Cefotaxima o ceftriaxona*** o vancomicina | 14-21 | |
| S. aureus | |||
| Meticilin-S | Cloxacilina | Si alergia a betalactámicos: vancomicina ± rifampicina | 10$$ |
| Meticilin-R | Vancomicina | Vancomicina ± rifampicina
Si CMI a vancomicina ≥ 1.5 mg/L elegir entre: linezolid$ o daptomicina($)± rifampicina |
10-14$$ |
| S. epidermidis | |||
| Meticilin-S | Cloxacilina | Si alergia a betalactámicos: vancomicina ± rifampicina | 10$$ |
| Meticilin-R | Vancomicina | Vancomicina. Si CMI a vancomicina ≥ 1.5 mg/L elegir entre: linezolid$ o daptomicina$ ± rifampicina | 10$$ |
| Enterococcus ssp. | |||
| Ampicilina-S | Ampicilina + gentamicina | Si alergia a betalactámicos vancomicina + tobramicina | 14-21 |
| Ampicilina-R | Vancomicina+ gentamicina | Si intolerancia a vancomicina: linezolid$ meropenem o daptomicina$ | 21 |
| Ampicilina-R y Vancomicina-R | Linezolid** | Si intolerancia a vancomicina: linezolid$, meropenem o daptomicina$ | 21 |
| L. monocytogenes | |||
| Ampicilina ± gentamicina | TMP-SMX, o meropenem | 21-28 | |
| Enterobacteriaceae spp+ | |||
| Cefotaxima o Ceftriaxona | Meropenem , fluorquinolona***, o aztreonam | 14-21$$ | |
| P. aeruginosa | |||
| Ceftazidima | Cefepima ó meropenem ó colistina ± aminoglucósido ± aminoglucósido intratecal# | 21 | |
| Cutibacterium spp.## | |||
| Penicilina GNa + rifampicina | Vancomicina, linezolid$ o daptomicina$ | 21 | |
| Bacillus spp. | |||
| Vancomicina + gentamicina | 21 | ||
| Candida spp. | |||
| Anfotericina liposomal ± 5-Fluorocitosina | Fluconazol& | 21 |
* a partir del último cultivo negativo
** en función de mantenimiento de shunt
*** Contraindicada en neonatos
**** Fluorquinolonas: El uso de fluoroquinolonas en niños se ve restringido a indicaciones específicas debido a reacciones adversas musculoesqueléticas y del sistema nervioso potencialmente irreversibles. En su indicación siempre hay que valorar el riesgo-beneficio. La fluorquinolona de primera elección sería Levofloxacino.
$ Esta indicación no figura en la ficha técnica de estos antibióticos.
$$Ver recomendaciones específicas en apartado 7 (Manejo y duración del tratamiento agrupado por microorganismo).
# Valorar en casos de multirresistencias que limitan las opciones de tratamiento sistémico. En caso de resistencia (carbapenemas) se debe consultar con el Servicio de Infectología Pediátrica.
+ Ajustar el tratamiento en función del estudio de sensibilidad: (A) si Enterobacteriae BLEE: meropenem (alternativa TMP/SMX); (B) si cepa productora de AmpC (p.ej. Enterobacter spp., Serratia spp., o Citrobacter spp.): meropenem (de elección) o levofloxacino (alternativa); (C) en caso de resistencia a carbapenemas: consultar con Servicio de Infectología Pediátrica.
## Anteriormente denominado Propionibacterium spp.
& Si mejoría clínica y comprobada la susceptibilidad del aislamiento se debe valorar modificar el tratamiento a fluconazol
- Pautas para la duración de tratamiento y el manejo en función del microorganismo:
- Solamente se dispone de recomendaciones de la IDSA del año 2017 para estas condiciones clínicas. Suelen ser recomendaciones de expertos, y tienen un bajo grado de recomendación-evidencia y no son específicas para la edad pediátrica.
- De forma general, un shunt infectado debe ser retirado y colocar de drenaje ventricular externo (DVE), hasta la reimplantación de un nuevo shunt
Se recomienda externalización de los shunts siempre que sea posible*,**
| Microorganismo | 2º Cultivo | LCR de control | Tratamiento |
| Staphylococcus spp. coagulasa negativos
y Cutibacterium spp. |
Negativo | Celularidad y bioquímica normal | Antibioterapia durante 10 días.
Reimplantar shunt a los 3 días de su retirada y valorar suspender antibioterapia con el cultivo post-reimplante negativo |
| Negativo | Alterado | Antibioterapia durante 10-14 días.
Reimplantación del shunt: 7 días de antibioterapia apropiada (suspender antibioterapia tras el último cultivo negativo, y características de LCR favorables). |
|
| Positivo | Antibioterapia durante 10-14 días.
Reimplantación del shunt: no antes de 7-10 días de cultivos negativos (valorar retirada y cambio de DVE). |
| Staphylococcus aureus | Antibioterapia: siempre mínimo de 10-14 días de antibioterapia a partir del primer cultivo negativo.
Reimplantación shunt: 7 días después del último cultivo negativo |
| Bacilos gramnegativos | Antibioterapia: 14-21 días
Reimplantación shunt: 7-10 días como duración mínima a partir del primer cultivo negativo antes de reimplantar el sistema. Tratamientos más prolongados pueden ser necesarios en función de la respuesta clínica. |
| Candida spp. | Antibioterapia: El tiempo óptimo de tratamiento no se ha determinado, pueden requerirse varias semanas.
Tiempo mínimo 21 días completando al menos 14 días desde el primer cultivo negativo. A partir de entonces se continuará el tratamiento hasta que el paciente esté asintomático, con cultivo(s) negativo(s) y alteraciones radiológicas resueltas. |
- Tratamiento antimicrobiano intratecal:
No está aprobado por la FDA ni por la EMA. Su recomendación es muy controvertida, aunque se utiliza de forma relativamente frecuente. Nunca reemplaza al tratamiento sistémico.
Valorar su uso en situaciones concretas con escasas alternativas terapéuticas (p.ej. gérmenes multirresistentes), en las situaciones excepcionales en las que el shunt no se puede retirar, cultivos persistentemente positivos pese a tratamiento medico-quirúrgico adecuado, LCR extremadamente patológico en las que la interrupción de otras terapias (p.ej. oncológicas) puede comprometer la vida del paciente.
Siempre consultar con asesor de PRIOAM.
- Infecciones por bacilos gramnegativos multirresistentes (cefalosporinas de 3ª, 4ª generación y meropenem), por cocos grampositivos resistentes a betalactámicos.
- Infección asociada a drenaje ventricular externo (DVE) o ventriculitis, sin alternativa de tratamiento sistémico disponible, sin mejoría clínica o esterilización del LCR, a pesar del tratamiento sistémico.
- Infección de derivación externa (DVE) cuando no es posible retirarlo o su recambio.
Duración: en función del patógeno aislado y negativización del cultivo (ver Anexo 2)
Dosificación y pauta de administración intratecal / intraventricular de los antimicrobianos en las infecciones del SNC*
| Antibiótico | Dosificación |
| Gentamicina | 1-2 mg/día |
| Amikacina | 30 mg/día |
| Tobramicina | 5-20 mg/día |
| Vancomicina | 10-20 mg/día |
| Colistina | 10 mg/día |
| Teicoplanina | 5-40 mg/día |
| Daptomicina | 10 mg/72 horas |
| Anfotericina B | 0,1-0,5 mg/día |
*La administración debe realizarse por expertos y con estrictas condiciones de asepsia y esterilidad. Hay que considerar el volumen del catéter y del sistema de drenaje para asegurar infusión intraventricular con arrastre adecuado. Debe cerrarse el drenaje al menos una hora post-infusíon (si la situación clínica del paciente lo permite), valorando a la vez potenciales situaciones de hipertensión intracraneal. En la actualidad no esta completamente establecido el régimen terapéutico de administración intratecal que debe individualizarse en cada caso.
ANEXOS
Anexo 1: Aislamientos de LCR (valvular y ventricular)
Hospital Infantil. Hospital Universitario Virgen del Rocío de Sevilla 2014-2019
| Microorganismos (n=159) | Aislamientos | |
| Nº | % | |
| Cocos grampositivos
Staphylococcus epidermidis Staphylococcus aureus Otros Staphylococcus spp. coagulasa negativos Enterococcus spp. Streptococcus spp. |
59 8 3 8 10 |
37,1% 5,0% 1,9% 5,0% 6,3% |
| Bacilos gramnegativos
Escherichia coli Pseudomonas aeruginosa Klebsiella pneumoniae Klebsiella aerogenes Enterobacter cloacae Acinetobacter spp. Serratia marcescens |
3 10 11 7 4 2 2 |
1,9% 6,3% 6,9% 4,4% 2,5% 1,3% 1,3% |
| Bacterias anaerobias
Cutibacterium acnes Prevotella spp. |
15 1 |
9,4% 0,6% |
| Otros
Neisseria meningitidis Listeria monocytogenes |
6 1 |
3,8% 0,6% |
| Hongos
Candida spp. |
10 |
6,3% |
Anexo 2: Algoritmo práctico sobre el manejo médico-quirúrgico de pacientes con sospecha de infección de shunt
Grafico-duración-de-tratamiento-infección-VDVP-Versión-finalOP.pdf (736 descargas) 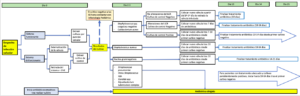
Anexo 3:
Actuación ante paciente pediátrico estable con dispositivo de drenaje de LCR y fiebre.
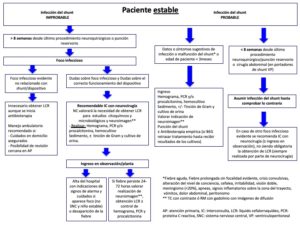
Anexo 4: Actuación ante un paciente pediátrico inestable portador de dispositivo de LCR y fiebre en Urgencias

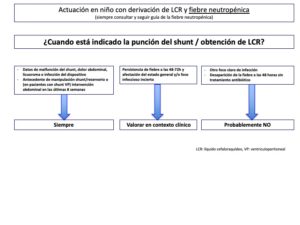
Anexo 5: Actuación en niños con derivación de LCR y FIEBRE NEUTROPÉNICA
- Bibliografía:
- Tamber MS, et al. Pediatric hydrocephalus: systematic literature review and evidence-based guidelines. Part 8: Management of cerebrospinal fluid shunt infection. J Neurosurg Pediatr. 2014;14 Suppl 1:60-71. doi: 10.3171/2014.7.PEDS14328
- Jiménez-Mejías ME, et al. Infection of cerebrospinal fluid shunt systems. Enferm Infecc Microbiol Clin. 2008;26:240-51. PMID: 18381044
- Zervos T, Walters BC. Diagnosis of Ventricular Shunt Infection in Children: A Systematic Review. World Neurosurg. 2019;129:34-44. doi: 10.1016/j.wneu.2019.05.057
- Rivero-Garvía M, et al. Reduction in external ventricular drain infection rate. Impact of a minimal handling protocol and antibiotic-impregnated catheters. Acta Neurochir (Wien). 2011 Mar;153(3):647-51. doi: 10.1007/s00701-010-0905-1
- van de Beek D,et al. Nosocomial bacterial meningitis. N Engl J Med. 2010;362:146-54. Arnell K, Enblad P, Wester T, Sjölin J. Treatment of cerebrospinal fluid shunt infections in children using systemic and intraventricular antibiotic therapy in combination with externalization of the ventricular catheter: efficacy in 34 consecutively treated infections. J Neurosurg.2007 Sep;107(3 Suppl):213-9. doi: 10.3171/PED-07/09/213
- Dawod J, et al. Prevention and management of internal cerebrospinal fluid shunt infections. J Hosp Infect. 2016;93:323-8. doi: 10.1016/j.jhin.2016.03.010
- Cleave B, et al. Fever in a child with cerebrospinal fluid access device or shunt: a pragmatic approach to management. Arch Dis Child 2016;0:1–5. doi: 10.1136/archdischild-2016-310449
- Simon TD, et al. Patient and Treatment Characteristics by Infecting Organism in Cerebrospinal Fluid Shunt Infection. J Pediatric Infect Dis Soc. 2019:235-243. doi: 10.1093/jpids/piy035
- Tunkel A , et al. 2017 Infectious Diseases Society of America’s Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clin Infect Dis 2017;64, e34–e65, https://doi.org/10.1093/cid/ciw861.
- Simon TD. Reinfection rates following adherence to Infectious Diseases Society of America guideline recommendations in first cerebrospinal fluid shunt infection treatment. J Neurosurg Pediatr. 2019;15:1-9. doi: 10.3171/2018.11.PEDS18373
- Jiménez-Mejías ME, Marquez-Rivas FJ. CNS infections in patients with temporary CSF shunts: diagnostic, preventive and therapeutic approach. Enf Infec Microbiol Clin. 2020; 38: 49-53. doi: 10.1016/j.eimc.2020.01.001