INFECCIÓN CATÉTER VASCULAR
Autores: Marta Macarena Rodriguez Lima, Walter Alfredo Goicochea Valdivia, María Jesús Sánchez Álvarez
| DEFINICIÓN | El diagnóstico de infección relacionada con catéter debe hacerse en base a la suma de los siguientes criterios clínicos y microbiológicos: | |||
| Criterios clínicos | ||||
| Infección local de la inserción:
|
Eritema, induración o dolor en los primeros 2 cm desde el punto de inserción del catéter. Puede asociar otros signos o síntomas como fiebre o salida de material purulento. | |||
| Infección local del túnel o tunelitis: | Infección del trayecto subcutáneo de catéter tunelizado. Eritema, dolor e induración a más de 2 cm del punto de inserción, que sigue el trayecto subcutáneo del catéter tunelizado.
|
|||
| Infección del reservorio canalizado | Líquido infectado alrededor del reservorio de un catéter tunelizado. Suele asociar dolor, eritema e induración. Puede drenar de manera espontánea | |||
| Bacteriemia/fungemia asociada a catéter venoso central(CVC) | Fiebre o signos de infección sistémica acompañados, o no, de signos de infección local en el catéter:
● Las infecciones de catéter periférico se acompañan de signos locales: dolor a la palpación, eritema y/o signos de tromboflebitis, con o sin supuración.
● Las infecciones de catéter central se acompañan de signos locales solo en un 30% de los casos. En un 70% de pacientes, la presentación clínica será fiebre sin foco.
|
|||
| Bacteriemia/fungemia relacionada con catéter (infección relacionada a CVC) | ● Bacteriemia confirmada cuyo origen es el CVC.
● Bacteriemia complicada relacionada con CVC: ○ Bacteriemia persistente: crecimiento del mismo germen en hemocultivo > 72 h tras inicio de antibioterapia adecuada y la retirada del catéter. ○ Endocarditis ○ Metástasis a distancia: osteomielitis, artritis… ○ Tromboflebitis séptica (hemocultivo positivo + trombo en relación al catéter +/- supuración).
|
|||
| Criterios microbiológicos | ||||
| Bacteriemia relacionada con catéter (BRC) de catéter periférico | ● Extraer DOS parejas de hemocultivos mediante dos venopunciones consecutivas (no es necesario esperar entre ambas). Realiza una única petición con el perfil “Micro_Hemocultivos” de MPA.
● Frotis de la inserción o cultivo de la punta del catéter (opcional, si los signos locales son dudosos o hay otros focos posibles para la fiebre o la bacteriemia). |
|||
| BRC catéter venosos central (CVC) | a) Sin retirada del catéter:
● Extraer al mismo tiempo hemocultivo de la luz o luces del catéter y un hemocultivo de sangre periférica por venopunción (o, alternativamente y menos exacto, extraer ≥ 2 hemocultivos de distintas luces del CVC). ● Realizar una única petición con el perfil “MICRO HEMOCULTIVO DIFERENCIAL PEDIÁTRICO” de MPA, donde la procedencia de cada muestra (venopunción o catéter central), se identifica mediante el tipo de etiquetas y/o rotulando los frascos. ● Muestra de exudado pericatéter si se objetiva supuración en el punto de inserción y signos locales de infección, ● Se establece el diagnóstico si crecimiento en hemocultivo central mayor que en periférico. El cultivo central es significativamente mayor que el periférico si: – El número de colonias es más de 3 veces superior en el hemocultivo central. – El crecimiento del germen se detecta al menos 2 h antes en el hemocultivo central que en el periférico. La valoración del tiempo diferencial siempre debe hacerse junto con el resto de datos clínicos de valoración del foco de la bacteriemia.
En el caso de gérmenes habitualmente contaminantes de la piel (ej. S. Coagulasa negativos), se exigen otra tanda de hemocultivos, 1 del CVC y 1 o más cultivos periféricos.
b) Con retirada del catéter. ● Cultivo de la punta del catéter y extraer hemocultivo de sangre periférica. ● Extraer DOS parejas de hemocultivos mediante dos venopunciones consecutivas (no es necesario esperar entre ambas). ● Realizar una única petición con el perfil “MICRO_HEMOCULTIVOS-PEDIATRICO_DIFERENCIAL” de MPA. ● Alternativamente, puede optarse por el procedimiento descrito en (a) antes de retirar el catéter. Se establece el diagnóstico mediante el aislamiento del mismo microorganismo en ambas muestras. |
|||
| Infección local de la inserción | ● Diagnóstico CLÍNICO.
● Si secreción purulenta en el punto de inserción: cultivo del exudado El FROTIS de la inserción NO ESTÁ INDICADO en ausencia de signos clínicos de infección. En estos casos, el aislamiento de bacterias debe interpretarse como una colonización. |
|||
| Infección del túnel o tunelitis | ● Diagnóstico clínico + cultivo de catéter
● Está indicado: retirar catéter (+/- desbridamiento de tejido infectado) y cultivo ● Hemocultivos según lo indicado en el apartado de BRC de catéter central, para descartar infección sistémica. |
|||
| Colonización catéter central | ● Crecimiento de microorganismos en el cultivo de cualquier segmento del catéter, sin que existan signos clínicos de infección local ni sistémica.
● Hemocultivo extraído del catéter positivo, o cultivo de la punta del catéter positivo, con hemocultivo periférico negativo, sin que existan signos clínicos de infección local ni sistémica. |
|||
| ETIOLOGÍA | Más frecuentes los gérmenes de la piel:
● Cocos Gram positivos (55%): Staphylococcus coagulasa-negativos (ECN) y en menor proporción Staphylococcus aureus o Enterococcus faecalis; ● Bacilos Gram negativos (45%): enterobacterias (Klebsiella spp., Enterobacter cloacae, E. coli, Serratia spp.) y P. aeruginosa ● Hongos levaduriformes (5%): Candida spp.
|
|||
| FACTORES DE RIESGO | -Factores de riesgo relacionados con catéter venoso central (CVC):
● Mayor riesgo los CVC temporales que los tunelizados y Port-a-cath (PAC) ● Mayor riesgo a mayor número de luces ● Mayor riesgo si tiene canalizado más de un CVC ● Más riesgo de infección si localización femoral ● Más riesgo a partir de > 7 días de CVC. ● Más riesgo si bacteriemia previa. -Bacilos Gram negativos: ● Pacientes graves ● Neutropénicos ● Foco conocido de infección por Bacilo Gram negativo – Bacilo Gram negativo multiresistentes: ● Sepsis ● Neutropénico ● Previamente colonizados – Infección fúngica (varios factores de riesgo de los siguientes y situación de gravedad): ● Inmunodeprimidos ● Nutrición parenteral ● Presión antibiótica o tratamiento corticoides prolongado ● Cirugía abdominal previa ● Pacientes con leucemia/linfoma ● Trasplante de médula ósea o de algún órgano ● CVC femoral ● Infección previa y/o colonización por Candida spp
– |
|||
| TRATAMIENTO ANTIMICROBIANO EMPÍRICO | Inicio del tratamiento | – En pacientes estables con poca repercusión clínica (febrícula, signos locales dudosos o ausentes) y sin factores de riesgo de bacteriemia complicada (prótesis valvulares, marcapasos), el tratamiento antimicrobiano puede demorarse a la recepción del resultado de los cultivos, especialmente si el catéter ha sido retirado por la sospecha.
– En pacientes con repercusión clínica significativa o signos locales significativos (supuración o tromboflebitis extensa) sí debe iniciarse precozmente el tratamiento empírico. |
||
| Sospecha Infección catéter venoso periférico | Sin sospecha de sepsis: | Cefazolina
*En pacientes con colonización previa por SARM o alérgicos a penicilina: Teicoplanina o Vancomicina |
||
| Con sospecha de sepsis | Cefotaxima o ceftriaxona + Teicoplanina | |||
| Sospecha Infección catéter central | Sin sospecha de sepsis, no colonizados por gérmenes resistentes:
|
Cefalosporina 3.ª o 4.ª generación (cefotaxima, ceftriaxona, ceftazidima o cefepime)
+ Teicoplanina
En pacientes alérgicos a penicilina: Aztreonam + Teicoplanina
*Valorar cobertura antifúngica (ver apartado factores de riesgo).
|
||
| Con sospecha de sepsis o neutropénico:
|
Cefepime o piperacilina tazobactam
+ Vancomicina o teicoplanina * Considerar dosis de antibióticos altas y en perfusión extendida tras primera dosis de carga (30min.) *Valorar cobertura antifúngica (ver apartado factores de riesgo). |
|||
| Neutropénico
inestable:
|
Meropenem
+ Vancomicina o teicoplanina +/- Amikacina* (si sospecha de infección por patógenos resistentes a carbapenems)
**Valorar cobertura antifúngica(ver apartado factores de riesgo).
|
|||
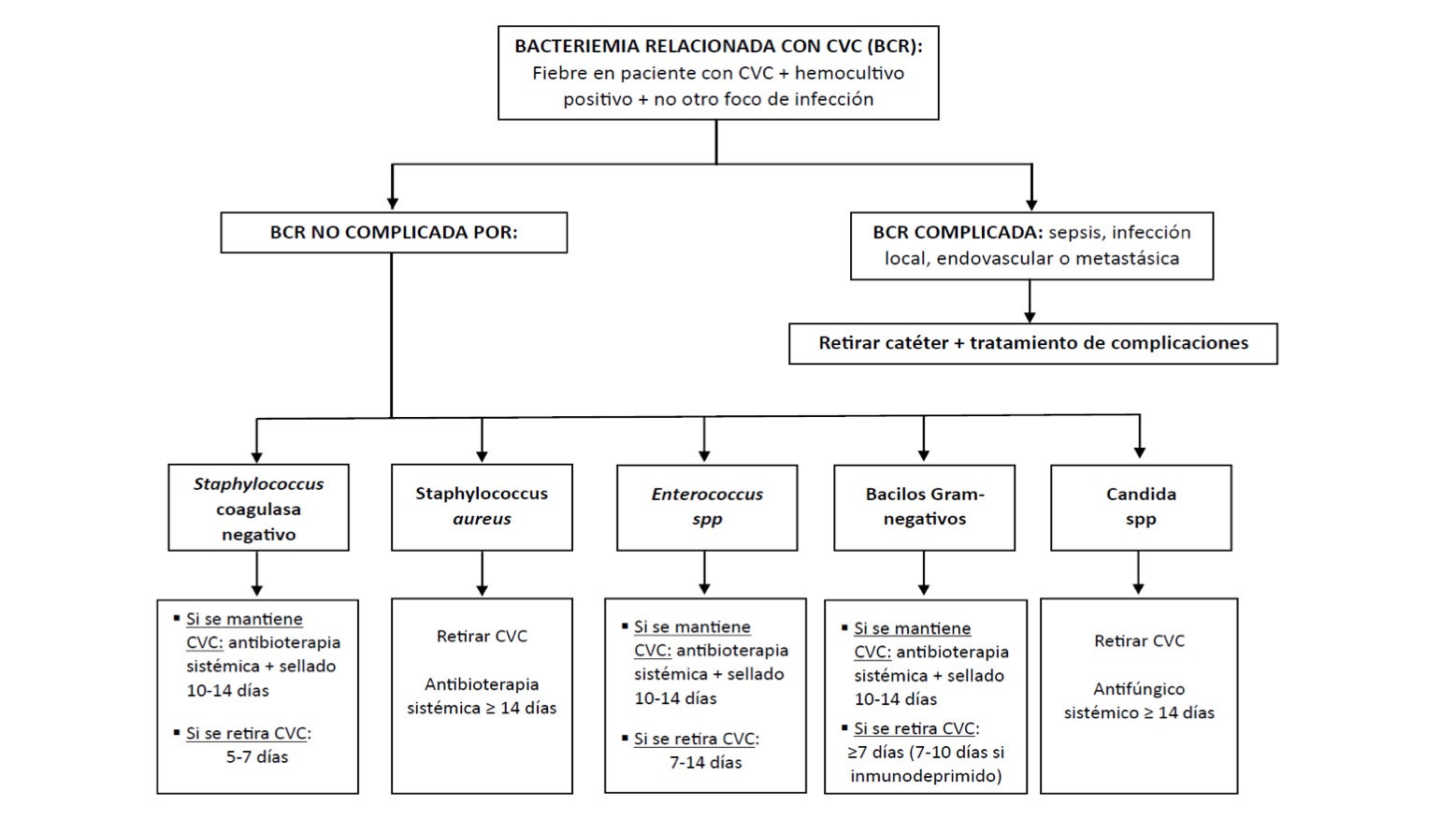
| TRATAMIENTO ANTIMICROBIANO DIRIGIDO***
(Ver tabla 1) |
Staphylococcus coagulasa negativo | Sensible a meticilina | Cefazolina | DURACIÓN: 5-7 días.
Si retirada del catéter: 5-7 días (3 días serían suficientes en pacientes con rápida respuesta y sin factores de riesgo). Si no se retira el catéter: tratamiento sistémico 10-14 días y con sellado antibiótico durante mínimo 10-14 días |
| Resistente a meticilina o alérgicos a penicilina | Teicoplanina o
Vancomicina |
|||
| Staphylococcus aureus | Sensible a meticilina | Cefazolina o
cloxacilina |
DURACIÓN: al menos 14 días tras 1º hemocultivo negativo.
Estudio de extensión si bacteriemia persistente, hemodiálisis, focos metastásicos, signos de endocarditis infecciosa (EI), dispositivos intravasculares o intracardiacos, válvula protésica, EI previa o anomalía estructural cardiaca: fondo de ojo, doppler venoso (descartar tromboflebitis) y ecocardiografía (en neonatos también ecografía cerebral y punción lumbar). Si complicaciones hematógenas o portadores de prótesis endovasculares: tratamiento durante 4-6 semanas |
|
| Resistente a meticilina o alérgicos a penicilina | Si CMI de vancomicina < 1.5 mg/L: Vancomicina.
Si fracaso renal o CMI de vancomicina ≥ 1.5 mg/L: Daptomicina o linezolid |
|||
| Enterococcus spp. | E. Faecalis | Ampicilina | DURACIÓN: 7-14 días
7 días en casos no complicados . Si no retirada de catéter: tratamiento durante 7-14 días sistémico y 10-14 días de sellado. |
|
| E. faecium | Teicoplanina o Vancomicina
Linezolid o daptomicina si resistencia a vancomicina. |
|||
| Bacilos Gram-negativos | Entero-
bacterias |
Según antibiograma.
Utilizar el espectro más reducido posible (ampicilina < cefalosporinas < piperacilina/tazobactam < carbapenemas) |
DURACIÓN: 7 – 14 días. Indicada la retirada del CVC, aunque eficacia reciente demostrada con tratamiento combinado con antibióticos sistémicos y sellado del catéter.
7 días si retirada del catéter. 10-14 días si no retirada del catéter asociando sellado del catéter.
|
|
| Pseudomonas aeruginosa | Utilizar el espectro más reducido posible (cefalosporinas < piperacilina-tazobactam < carbapenemas) | |||
| Candida sp*. | ||||
| Candida glabrata y
C. krusei |
Caspofungina
o micafungina o Voriconazol |
|||
| C. parapsilosis resistente a fluconazol | Caspofungina
o micafungina o Anfotericina B |
|||
| RETIRADA DEL
CATÉTER |
– Bacteriemia complicada
– Sepsis grave. – Persistencia hemocultivo positivo > 72 h. – Tromboflebitis supurada, endocarditis, osteomielitis o émbolo séptico. – Pus en el punto de entrada. – En caso de infección por S. aureus, Enterococcus sp, bacilos gram-negativos, hongos o micobacteria (en los catéteres de larga permanencia: S. aureus, P. aeruginosa, hongos y micobacterias), salvo casos excepcionales (imposibilidad de canalización de una nueva vía). – Bacteriemia persistente: > 72h, habiendo conservado el CVC y con antibioterapia adecuada (requiere 2 hemocultivos positivos del mismo día, o sólo 1 en neonatos). – En el caso de Bacillus spp, Micrococcus spp o Propionibacterium que son gérmenes poco virulentos, pero difíciles de erradicar, se recomienda retirar tras descartar contaminación, mediante múltiples hemocultivos positivos, al menos 1 de ellos periférico. ● Valorar el tipo de catéter (temporal/permanente/ facilidad de inserción de otro, estado inmunológico/enfermedad de base y la infección. Si se decide la retirada del CVC por gravedad clínica, no demorar más de 12 horas. En catéteres de larga duración conviene retrasar la inserción de uno nuevo 24-48 horas (5 días para Candida sp.).
|
|||
| SELLADO CATÉTER | – Esta técnica permite instilar grandes concentraciones de antibiótico al cual el germen es sensible, dentro de la luz del catéter, sin toxicidad sistémica y evitar la retirada del catéter.
– El volumen de antibiótico introducido depende del volumen catéter (1-3 ml), y se extrae antes de administrar la siguiente medicación. – Si debido a la alta sospecha de infección de catéter se inicia sellado de forma empírica y no existe una colonización previa que indique lo contrario, se utilizará vancomicina 10 mg/ml, ajustando tras aislamiento microbiológico y antibiograma. – La solución de antibiótico + diluyente (SSF / heparina) la prepara la UGC de Farmacia. – Debe ir siempre acompañado de antibioterapia sistémica, excepto en los casos de colonización del catéter por Staphylococcus coagulasa negativos o bacilos gram-negativos con hemocultivos periféricos reiteradamente negativos, en los que se puede tratar con el sellado del catéter exclusivamente, durante 10-14 días. – Mantener el sellado del catéter más antibioterapia sistémica de 7 a 10 días (en el caso excepcional de conservación del catéter en BCR por S. Aureus, mantener 4 semanas). – El tiempo de sellado debe ser mayor a 8 horas, pero no debe exceder las 48 h (dependiendo de la estabilidad del fármaco). – En caso de catéteres con múltiples luces infectadas, se debe intentar sellar todas las luces con la solución antibiótica. – En caso de iniciarse tratamiento de sellado, es necesario confirmar la respuesta clínica y realizar hemocultivos de control a las 72-96 h para confirmar la negativización. – Durante el sellado, idealmente no debe utilizarse el catéter.
|
|||
| ANTIBIÓTICO | DOSIS INTRAVENOSA
*Dosis alta: dosis recomendada en infecciones por microorganismos sensibles a exposición incrementada (“I”). |
|||
| Aztreonam | Dosis estándar: 90-120 mg/kg/día cada 6-8 horas
Dosis alta: 150 – 200 mg/kg/día cada 6 horas (máximo 8 g/día) |
|||
| Amikacina | 15-22,5 mg/Kg/día cada 24 horas (máximo 1,5 g/día)
Considerar 22-30 mg/kg/día cada 24 horas en pacientes con shock. |
|||
| Cefazolina | 100-150 mg/kg/día cada 8 horas (máximo 3 g) | |||
| Cefepime | Dosis alta (riesgo Pseudomonas, neutropénico): 150 mg/kg/día cada 8 horas (máximo 6 g/día) | |||
| Ceftazidima |
Dosis alta: 200-300 mg/kg/día cada 8 horas (máximo 8 g/día) |
|||
| Ceftriaxona | 50-75 mg/kg/día cada 12-24 horas (máximo 4 g/día) | |||
| Cefotaxima | Dosis estándar: 100 -150 mg/kg/día cada 8 horas
Dosis alta: 200 mg/kg/día cada 6-8 horas (máximo 12 g/día) |
|||
| Cloxacilina | 100-150 mg/kg/día cada 6 horas (máximo 12 g /día) | |||
| Daptomicina | 1-6 años: 12 mg/kg/día cada 24 horas
7-11 años: 9 mg/kg/día cada 24 horas > 11 años: 7-12 mg/kg/día cada 24 horas |
|||
| Linezolid | ≤12 años: 30 mg/kg/día cada 8 horas
> 12 años: 600 mg cada 12 horas |
|||
| Meropenem
|
Dosis estándar: 60 mg/kg/día cada 8 horas
Dosis alta (infecciones graves): 120 mg/kg/día cada 8 horas (máximo 6 g/día) |
|||
| Piperacilina tazobactam | Dosis estándar: 300-400 mg/Kg/día cada 6 horas
Dosis alta: 400 mg/kg/día cada 6 horas en perfusión extendida 4h (máximo 16g/día). |
|||
| Teicoplanina
|
Dosis estándar:
≤12 años: 10 mg/kg/12h (3 dosis) y cada 24 horas posteriormente IV (máximo 400 mg/dosis). > 12 años: 6 mg/kg/12h (3 dosis) y cada 24 horas posteriormente IV (máximo 400 mg/dosis). Dosis altas (infecciones graves): 12 mg/kg/12h (3 dosis) y cada 24h posteriormente IV (máximo 800 mg/dosis). |
|||
| Vancomicina | Dosis estándar:
≤12 años: 45 mg/kg/día cada 6-8 horas > 12 años: 45 mg/kg/día cada 8-12 horas Dosis altas (infecciones graves o por S. aureus con CMI > 1 mg/L): ≤12 años: 60-80 mg/kg/día cada 6 horas > 12 años: 60-80mg/kg/día cada 8 horas (máximo 4g/día). *En infecciones graves: dosis de carga de 15-20 mg/kg seguido de perfusión continua a 40-60 mg/kg/día.
Monitorizar niveles plasmáticos: objetivo niveles valle de 15-20 mcg/mL en perfusión intermitente y 20-25 mcg/mL en perfusión continua |
|||
| ANTIFÚNGICO | DOSIS INTRAVENOSA | |||
| Anfotericina B liposomal | 3-5 mg/kg/día cada 24 horas | |||
| Fluconazol | Dosis de carga: 6-12 mg/kg/24 horas (1 día)
Dosis de mantenimiento: 3-12 mg/kg/24 h (máximo 800 mg/día) |
|||
| Voriconazol | Niños y adolescentes jóvenes (12-14 años con peso <50 kg):
– Dosis de carga: 9 mg/kg/12 horas (1 día) – Dosis de mantenimiento: 8 mg/kg/12 horas Adolescentes de 12-14 años con peso ≥ 50 kg y adolescentes ≥ 15 años: – Dosis de carga: 6 mg/kg/12 h (1 día) – Dosis de mantenimiento: 4 mg/kg/12 h Monitorizar niveles plasmáticos, objetivo: 1-5 mg/l |
|||
| Caspofungina | Dosis de carga: 70 mg/m2/24 h (día 1) (máximo 70 mg)
Dosis de mantenimiento: 50 mg/m2/24 h (máximo 70 mg) |
|||
| Micafungina | <40 kg: 2 mg/kg/día
≥ 40 kg: 100 mg/día |
|||
*La incidencia de casos de pacientes con resistencia a carbapenems en nuestro centro es muy baja (1-2 casos al año) en Pacientes que han recibido ciclos prolongados con carbapenems, colonización previa, o que vengan de sitios de alta prevalencia (ingresos prolongados en hospitales terciarios de Barcelona o Madrid, o que provengan de Sudamérica, África, Oriente Medio y Sudeste asiático).
**Valorar cobertura antifúngica ante sospecha de candidemia en los pacientes sépticos con alguno de los factores de riesgo (ver apartado “Factores de riesgo”):
- Paciente no neutropénico, estable, que no haya recibido profilaxis/tratamiento previo con azoles → FLUCONAZOL. Alternativa EQUINOCANDIDA.
- Paciente que haya recibido recientemente azoles, paciente con enfermedad moderada o grave, con inestabilidad hemodinámica o en pacientes con riesgo de infección por C. glabrata o C. krusei → EQUINOCANDIDA (Micafungina en el paciente no neutropénico y Caspofungina en el neutropénico). Alternativa ANFOTERICINA B LIPOSOMAL.
- Paciente neutropénico: de elección ANFOTERICINA B LIPOSOMAL, CASPOFUNGINA O VORICONAZOL.
*** En el tratamiento siempre que sea posible deberá retirarse el catéter infectado. La duración total del tratamiento se contabiliza desde el primer hemocultivo de control negativo lo cual implicaría hemocultivos seriados que por restricciones de volumen no se suelen realizar de rutina en pediatría, dejando esta estrategia cuando el paciente no responda rápidamente o aislamientos de Candida sp, S. aureus, bacilos gram negativos multirresistentes y bacterias difíciles de erradicar (Bacillus spp, Micrococcus spp o Propionibacterium). En el resto de situaciones, si el paciente responde clínicamente de forma precoz (afebril en 24 horas), se puede optar por extraer el primer hemocultivo de control a las 48-72 hrs, y si este es negativo, ajustar la duración total del tratamiento contabilizando desde el primer día de tratamiento. Si el hemocultivo de control es negativo, se contabilizarán los días desde el primer hemocultivo negativo.
Estudios en adultos sugieren que es seguro el paso a vía oral en pacientes con BRC siempre y cuando cumplan los siguientes supuestos: catéter infectado retirado, infección no complicada y no factores de riesgo, afebril a las 24-48 horas, cultivo de control negativo, haber completado de 3-9 días (5 días en promedio) de tratamiento intravenoso, adecuada tolerancia oral y no alteración de la absorción intestinal y alternativa antibiótica con buena biodisponibilidad (fluorquinolonas, trimetoprim-sulfametoxazol, linezolid o fluconazol).
Tabla 1. Duración de la antibioterapia en BRC según clínica y microorganismo implicado
Fuente: Chesshyre E, Goff Z, Bowen A, Carapetis J. The prevention, diagnosis and management of central venous line infections in children. J Infect [Internet]. 2015;71(S1):S59–75.
BIBLIOGRAFÍA
- Mermel LA, Allon M, Bouza E et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 update by the infectious diseases society of America. Clin Infect Dis. 2009;49(1):1–45.
- Figueras C, Heredia CD De, García JJ, et al. The Spanish Society of Paediatric Infectious Diseases (SEIP) recommendations on the diagnosis and management of invasive candidiasis. An Pediatr. 2011;74(5).
- Márquez Luque R, Sacaluga GIL L, Pallás Aldabó T et al. Infecciones de catéter vascular. Guía PRIOAM. 2023.
4.. Rupp ME, Karnatak R. Intravascular Catheter–Related Bloodstream Infections. Infect Dis Clin North Am [Internet]. 2018;32(4):765–87. Disponible en: https://doi.org/10.1016/j.idc.2018.06.002
5 Tabla de dosis de antibióticos en pediatría. Sociedad Española de Infectología Pediátrica (SEIP). Versión. 2021.
- Sánchez Granados JM, Serrano Ayestarán O, González Salas E, Gutiérrez Marqués S. Protocolo de infección relacionada con el catéter venoso central. Soc Española Cuid Intensivos Pediátricos. 2020;1–20.
- Chaves F, Garnacho-Montero J, Del Pozo JL et al. Diagnosis and treatment of catheter related bloodstream infection. Clinical Guidelines of the Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC) and the Spanish Society of Intensive Care Medicine and Coronary Units (SEMICYUC). Med Intensiva. 2018;42(1):5-36.
- Alonso-Martínez C., Mendoza-Palomar N. Fernández-Polo A., Soler-Palacín P. Antifúngicos sistémicos en pediatría (versión 1.0/2021). En Guía- ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [en línea] .Consultado el 03/06/2024. Disponible en http://www.guia-abe.es
9. Saavedra-Lozano J, Slocker-Barrio M, Fresán-Ruiz E et al. Consensus document of the Spanish Society of Paediatric Infectious Diseases (SEIP) and the Spanish Society of Paediatric Intensive Care (SECIP) for the diagnosis and treatment of central venous catheter-related infections in paedia