AUTORES: Rafael Hinojosa Pérez (coordinador)1 , Ángel Herruzo avilés1, Laura Herrera Hidalgo2 , Luis Gil3, Virginia Cabello3, Francisco de la Cerda4, Maria Victoria Gil Navarro2 Julia Mª Praena Segovia5
UNIDADES CLINICAS: 1Cuidados Críticos y Urgencias de Adultos, 2Farmacia 3Nefrología,4Pediatría y UCEIMP 5.
El ajuste de dosis de antimicrobianos en los pacientes con las terapias de soporte renal y cardiorrespiratoria es bastante dificultoso por los cambios que se producen en la farmacocinética y farmacodinamia de los pacientes críticos.
La farmacocinética observada en pacientes renales crónicos no es generalizable al paciente crítico y orientaciones sobre las dosis de los antibióticos no son a menudo referidas en la ficha técnica de los mismos cuando el enfermo es sujeto a este tipo de terapias de soporte.
Las guías para dosificar medicamentos anti-infecciosos en estos pacientes, soslayan este aspecto por la escasa disponibilidad de datos; y por ello, la monitorización sérica debe ser considerada primordial cuando es posible.
Cuando se utilizan este tipo de técnicas podemos infradosificar los fármacos con un notable impacto sobre la supervivencia o sobredosificar con la aparición de efectos adversos. La cantidad del fármaco eliminado dependerá de:
- La modalidad terapéutica empleada (convección y/o difusión).
- Lugar de reposición de fluidos en las técnicas de convección (prefiltro y/ó postfiltro) influyen en la concentración de los fármacos.
- La dosis de convección y difusión.
- Superficie y material del filtro (hay cierto grado de adsorción de las drogas en los filtros de poliacrilonitrilo y polimetil-metacrilato).
NORMAS GENERALES
A – La dosis de carga. Estos pacientes al ampliar el volumen de distribución (Vd), requieren el empleo de una dosis inicial mayor, para lograr unas apropiadas concentraciones de antibióticos terapéuticas precozmente. La dosis de carga no varía en función del aclaramiento de la molécula, sólo en función del volumen de distribución. Dosis de carga = Concentración deseada (Cdeseada)x Vd.
B – Dosis de mantenimiento. Existen varios métodos para ajustar las dosis en estas circunstancias:
Matzke GR. et al. Drug dosing consideration in patients with acute and chronic kidney disease – a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney International 2011.
- Basado en el aclaramiento de creatinina. Sumamos el aclaramiento renal residual de los pacientes junto al aclaramiento exógeno añadido por la terapia de soporte, y sobre éste, dosificamos siguiendo las recomendaciones de las guías de práctica clínica. Uno de los principales problemas es que estos fármacos no sólo son filtrables, en ocasiones también son excretables o reabsorbibles a nivel tubular con el riesgo de sobredosificar o infradosificar el antimicrobiano.
- Basados en la Fracción de Aclaramiento. Ajustamos la dosis dependiendo de los siguientes cálculos:
Cl = CLR + ClNR + ClEC. Aclaramiento total = Aclaramiento renal + Aclaramiento no renal + Aclaramiento extracorpóreo.
- Para calcular el aclaramiento extracorpóreo ClEC:
- Pacientes con terapia renal en modo convectivo (Hemofiltración). (HFVVC – Hemofiltración veno-venosa continúa)
- ClEC convectivo = S x Quf (ml/min).
- S = Coeficiente de cribado = Cuf / (Cart + Cvena)/2).
- S es la proporción de una molécula que atraviesa una determinada membrana. Volumen de ultrafiltrado por unidad de tiempo (Quf) es la dosis de convección + extracción total de líquido (balance negativo).
- Concentración de la sustancia que estamos ajustando su dosis, a nivel del ultrafiltrado (Cuf), prefiltro (Cart) y postfiltro(Cvena)
- Cuando la reposición de líquidos en los métodos de convección (hemofiltración) lo administramos prefiltro, hay un efecto de dilución con reducción del aclaramiento total. En ese caso, la fórmula anterior (2) quedará de la siguiente manera:
- ClEC convectivo con reposición prefiltro = S x Quf x (Flujo de sangre (QB) / Flujo de sangre (QB) + Flujo de reposición prefiltro QRpref)
- Pacientes con terapia renal con modo difusivo (HDVVC Hemodiálisis veno-venosa continúa):
- ClEC difusivo = S x Qd (ml/min)
- Qd = Dosis / Flujo de diálisis
- ClEC difusivo = S x Qd (ml/min)
- Cuando se emplean ambos modos de terapia conjuntamente (HDFVVC Hemodiafiltración veno-venosa continúa):
- ClEC convectivo + difusivo = (S x Quf) + (S x Q d)
- Si no conocemos S o no podemos calcularla, podemos sustituirla por alfa (α) que representa la fracción libre no unida a proteínas de la molécula analizada
- Pacientes con terapia renal en modo convectivo (Hemofiltración). (HFVVC – Hemofiltración veno-venosa continúa)
Para que una vía de aclaramiento sea considerada clínicamente significativa debe ser mayor del 25 – 30% del aclaramiento total de una sustancia (las moléculas deben tener una baja unión a proteínas, escaso volumen de distribución y eliminación predominantemente renal para ser significativa su eliminación por las terapias de soporte renal).
Si recordamos la primera fórmula de este apartado:
Cl = CLR + ClNR + ClEC.
Ajustamos la dosis del fármaco mediante la fracción del aclaramiento extracorpóreo de la molécula con respecto al aclaramiento no renal y de la función renal residual:
- FClEC = ClEC / (CLNR + CLR)
Una vez, resuelto el coeficiente previo, tenemos 2 opciones:
- Ajustamos la dosis basado en la dosis en situación de normalidad: Dosis con TDE = Dosis normal x FClEC.
- Basada en la dosis con fallo renal: Dosis con TDE = Dosis FRA x (1 – FClEC) o Intervalo con TDE = Intervalo en FRA x (1 – FClEC)
Para fármacos sin riesgo tóxico, los resultados de las formulaciones empíricas se deben aumentar en un 20 al 30%, evitando el riesgo de la infradosificación.
Los intervalos de dosis deben adaptarse a las características farmacocinéticas y farmacodinámicas. Para compensar la nueva ruta de eliminación, se deberá seleccionar si aumentar la dosis disminuyendo el intervalo que tendría en situaciones de FRA sin TDE (fármacos concentración dependiente) o disminuyendo el intervalo con / sin aumento de dosis (fármacos tiempo dependientes)
Objetivos bactericidas de antibióticos con respecto a las características farmacocinéticas y farmacodinámicas.
| Clasificación de los antibióticos | Definición de Objetivo
PK / PD |
Objetivo PK / PD |
| Concentración – dependiente | Ratio de concentración pico del antibiótico con respecto a CMI del germen (Cmáx / CMI) | Aminoglucósidos (Cmáx / CMI) 8:10
Daptomicina (Cmáx / CMI) 8:10 AUC0-24 /CMI 100 |
| Tiempo – dependiente | Porcentaje de tiempo durante los intervalos de dosis para la cual la concentración plasmática libre del antibiótico permanece mayor que la CMI del patógeno (%fT> CMI) | Betalactámicos 50 – 70% (%fT> CMI) Carbapenems > 40% (%fT> CMI)Linezolid 40 – 80% (%fT> CMI) |
| Concentración – dependiente con tiempo – dependencia | Ratio del área bajo la curva tiempo – concentración (AUC) durante 24 horas, con respecto a la CMI (AUC0-24 /CMI) | Fluoquinolonas (Cmáx / CMI) 10 AUC0-24 /CMI 125 (Ciprofloxacino en Gram negativos)
Glicopéptidos AUC0-24 /CMI > de 400 (Vancomicina para Stafilococo aureus) Colistina AUC0-24 /CMI 53 – 141 (Pseudomonas aeruginosa) |
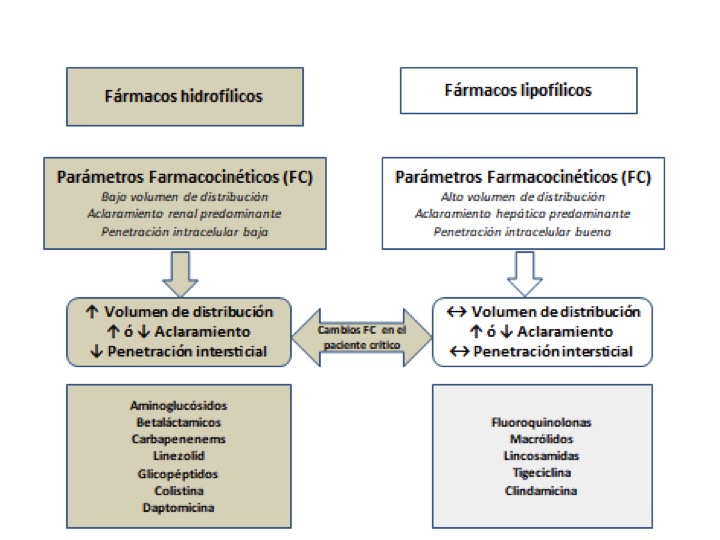
Figura. La asociación entre características físico-químicas de los antibióticos y posibles alteraciones de los parámetros farmacocinéticos en la enfermedad crítica.
- Literatura sobre eliminación de fármacos durante la TDE. Cuando existen datos de aclaramientos disponibles, las recomendaciones en la bibliografía actual deben ser el punto de partida lógico para dosificar la terapia. Diferentes dosis y modalidades terapeúticas con las técnicas de reemplazo renal, dan lugar a una enorme variabilidad en el aclaramiento de las drogas por lo que no podemos generalizar su uso en las múltiples prescripciones de terapia renal empleadas en la actualidad. Éstos son estudios realzados sobre bases poblacionales pequeñas y aunque existen varias recomendaciones de ajuste de dosis publicadas que son ampliamente utilizadas, nunca han sido validadas prospectivamente, y especialmente, no se han valorado su impacto en el pronóstico vital de los pacientes.
Choi G, Gomersall CD, Tian Q, et al. Principles of antibacterial dosing in continuous renal replacement therapy. Crit Care Med 2009; 37: 2268– 2282.
Golightly LK 2013. Renal Pharmacotherapy. Springer Verlag
Roberts R A et al. What’s new in pharmacokinetics of antimicrobials in AKI and RRT? Intensive Care Med 2017;43:904-6
- Niveles plasmáticos. La estrategia más efectiva para optimizar la terapia antimicrobiana es emplear la monitorización de las drogas para lograr los objetivos terapéuticos deseados. Sin embargo, muy pocas drogas tienen ensayos prácticos para su monitorización eficaz (habitualmente, con tiempos para la obtención de resultados prolongados). Es la referencia obligada en los casos de rango terapeútico estrecho y objetivos farmacocinéticos bien establecidos.
- La dosis se calculan con la ecuación:
- Dosis = Cdeseada – Cactual) x Vd x kg.
- Cdeseada y Cactual = Concentración deseada y actual del fármaco monitorizado
| Características del agente antimicrobiano | Ajuste de dosis | Drogas |
| Bajo Vd + Aclaramiento renal normalmente elevado
El aclaramiento extracorpóreo es una parte significativa del total |
Requieren dosis adicionales, comparado con los pacientes sin función renal residual (anéfricos) | Aminoglucósidos
Piperacilina / Piper-Tazobactam Amoxicilina / Amox-Clavulánico Ampicilina / Ampi-Sulbactam Cefepime Cefotaxima Ceftazidima Ertapenem Imipenem Meropenem Aztreonam Vancomicina Teicoplanina Daptomicina Colisitina Fosfomicina |
| Alto Vd + Aclaramiento renal normalmente elevado
El aclaramiento extracorpóreo es una parte significativa del total |
Requieren dosis adicionales, comparado con los pacientes sin función renal residual (anéfricos) | Levofloxacino |
| Alto Vd + Aclaramiento renal normalmente variable
El aclaramiento extracorpóreo es una parte variable del total |
Pueden requerir dosis similares a los pacientes con disfunción renal leve o moderadamente alterada | Ciprofloxacino |
| Aclaramiento renal normalmente bajo.
El aclaramiento extracorpóreo es una parte escasa del total (< del 30%) |
Requieren dosis similares a los pacientes con normal función renal | Ceftriaxona
Oxacilina Moxifloxacino Clindamicina Linezolid Tigeciclina |
ECMO
Los pacientes con ECMO representan un grupo controvertido por la escasez de datos que disponemos aunque se sugiere que requieren dosis más alta de lo normal incluso en la presencia de disfunción pluriorgánica.
Generalmente, ECMO incrementa el volumen de distribución para ciertas drogas y altera la unión a proteínas en el circuito. Las diferentes características de la técnica (composición de la tubuladura, tasas de flujos….) no permiten extraer conclusiones de la farmacocinética entre los diversos estudios realizados en este campo.
Shekar K, Fraser J, Smith M, Roberts J. Pharmacokinetic changes in patients receiving extracorporeal membrane oxygenation. J Crit Care 2012; 27: 741 e9-18.
Mousavi S, Levcovich B, Mojtahedzadeh M. A systematic review on pharmacokinetic changes in critically ill patients: role of extracorporeal membrane oxygenation. Daru 2011; 19:312–321.
La adsorción de drogas lipofílicas en las membranas y tubuladuras es común, con una reducción significativa de la concentración plasmática en algunas ocasiones. No todas las drogas son afectadas y la extensión del secuestro no es consistente
Los mecanismos que influyen en la farmacocinética de las drogas durante la técnica de ECMO es su secuestro en el circuito, volumen de distribución elevado, eliminación reducida y adsorción directa en la membrana. Los antimicrobianos altamente lipofílicos con un gran volumen de distribución (voriconazol) son marcadamente secuestrados en el circuito. En contraste, los antimicrobianos hidrofílicos con un pequeño volumen de distribución están más inclinados a hemodilución y adsorción directa por la membrana. La hemodilución matemáticamente incrementa la proporción de plasma y por tanto, disminuye la concentración de sustancias hidrosolubles y además, altera la unión a proteínas.
Como visión general en el uso de fármacos en este escenario, empleamos las siguientes dos tablas, de carácter descriptivo sobre las propiedades que favorecen que una molécula sea más susceptible de ser retenida en el circuito extracorpóreo.
| VOLUMEN DE DISTRIBUCIÓN (Vd) y DOSIS DE CARGA (DC) | ||
| Volumen de distribución | Alteraciones del Vd esperadas | Ajuste requerido |
| Vd < 1 L/kg | ↑ moderado-alto | ↑ la dosis de carga |
| Vd > 1 L/kg | ↑ mínimo | No afecta la dosis de carga |
| SECUESTRO EN EL SISTEMA EN FUNCIÓN DE LA LIPOFILIA Y GRADO DE UNIÓN A PROTEÍNAS | |||
| Coeficiente de partición Octanol /agua | Grado de unión a proteínas plasmáticas | ||
| < 30% | 30-70% | >70% | |
| < 1 | Mínimo | Mínimo-moderado | Moderado |
| 1-2 | Mínimo-moderado | Moderado | Moderado-Alto |
| 2 | Moderado | Moderado-Alto | Alto |
- Mínimo: No se recomienda ajuste de dosis
- Moderado: Puede requerir aumento de la dosis, del tiempo de infusión o de la frecuencia de infusión.
- Alto: Se recomienda aumento de la dosis, del tiempo de infusión o de la frecuencia de infusión.
Los datos clínicos obtenidos durante la ECMO son escasos y la mayor parte provienen de neonatos.
Aminoglucósidos. A la espera de datos concluyentes, es razonable administrar una dosis de amikacina de carga de 35 mg/kg en pacientes con ECMO veno-arterial (al reducir esta técnica el flujo pulmonar y la disponibilidad de esta droga en el pulmón).
Betalactámicos:
Carbapenemes. Son antibióticos tiempo dependientes, siendo eficaces cuando se alcanzan concentraciones > del 40% de los intervalos de dosis por encima de la CMI.
Meropenem es degradado y secuestrado significativamente en el circuito después de 4 – 6 horas de la administración de la dosis. Se sugiere administrar 1-2 gramos cada 6 – 8 horas en infusiones de 3 horas y monitorizar si es posible.
Penicilinas: Piperacilina-Tazobactam se mantiene estable a temperatura ambiente durante las 24 horas, siendo posible administrarla sin problemas en pc. extendida o continua. Se asume una dosis de carga de 4 gramos, seguido por una pc. de 16 gramos al día.
Cefalosporinas: No existen estudios clínicos concluyentes. Es probable un aumento del volumen de distribución y una reducción del aclaramiento. Se recomienda dosis de carga y de mantenimiento del paciente crítico. Ceftriaxona y Cafazolina son secuestradas alrededor del 20% en el sistema. Monitorizar si es posible.
Ceftolozano-Tazobactam. Se recomienda dosis de 1 gr/8 horas.
Ahsman MJ, Wildschut ED, Tibboel D et al. Pharmacokinetics of Cefotaxime and Desacetylcefotaxime in Infants during Extracorporeal Membrane Oxygenation. Antimicrobial Agents and Chemoth. 2010, 1734–41.
Zuppa AF, Zane NR, Moorthy G et al. A Population Pharmacokinetic Analysis to Study the Effect of Extracorporeal Membrane Oxygenation on Cefepime Disposition in Children. Pediatr Crit Care Med. 2019;20:62-70.
Arena F, Marchetti L, Henrici De Angelis L et al. Ceftolozane-Tazobactam Pharmacokinetics during Extracorporeal Membrane Oxygenation in a Lung Transplant Recipient. Antimicrob Agents Chemother. 2019; 63.
Glucopéptidos:
Vancomicina. La necesidad de una dosis de carga se justifica porque los niveles de vancomicina en el 95% de los pacientes con ECMO permanecen a niveles subterapéuticos durante más de 3 días con la dosificación convencional. La vancomicina es hidrofílica y grandes cantidades de volumen de plasma son reemplazados durante la técnica, por lo que la concentración plasmática de vancomicina durante la fase inicial del procedimiento puede ser baja. Se aconseja una dosis de carga de 30 mg/kg en 4 horas
La estrategia de dosificación actual utilizada no está bien establecida porque la mayor parte de los estudios solo contemplan las primeras 48 a 72 horas de tratamiento. Se recomienda una dosis de mantenimiento: 15 a 20 mg / kg / cada 12 horas en pc y monitorizar niveles.
Teicoplanina Por su alta unión a proteínas es complicado dosificarla en situaciones de hipoalbuminemia.
La teicoplanina fue bien descrita por un modelo farmacocinético bicompartimental con eliminación de primer orden. La presencia de ECMO se asoció con un volumen de distribución central más bajo, y la terapia de reemplazo renal continua (CRRTó TDE) con un mayor volumen periférico de distribución.
Para infecciones leves a moderadas, una dosis óptima es una dosis de carga (DC) de 600 mg y una dosis de mantenimiento (DM) de 400 mg para pacientes con ECMO no recibiendo TDE; y una DC de 800 mg y una DM 600 mg para aquellos que reciben TDE.
Para infecciones graves, una dosis óptima de carga es de 1000 mg y una DM de 800 mg para ECMO pacientes no recibiendo TDE; y una DC 1200 mg y una DM 1000 mg para aquellos que reciben TDE. En conclusión, más alta que las dosis estándar son necesarias para lograr rápida y apropiada exposición a teicoplanina durante ECMO.
Un reciente estudio demostró una masiva adsorción de Teicoplanina en ECMO con membranas de polisulfona acrilonitrilo.
No disponemos de TDM de teicoplanina para asegurar la seguridad y eficacia de estas dosis.
Linezolid es un antibiotic hidrofílico. Investigaciones recientes, favorecen dosis mayores de 600 mg durante la terapia con ECMO; sin embargo, su potencial toxicidad debe ser tenida en cuenta. Se sugiere que se debe considerar un aumento de la dosificación para gérmenes aislados con CIM> 1 mg / L (DC: 600 mg y DM de 1200 mg en pc). Monitorizar niveles para evitar efectos adversos.
Fluoroquinolonas:
Ciprofloxacino, es un antibiótico lipofílico con un alto Vd y con secuestro en la terapia con ECMO. Se sugiere el empleo de una dosis de carga de 800 mg. seguido de 400 mg cada 8 horas o 600 mg/12 horas.
Se emplean las dosis habituales en otros fármacos incluidos en este grupo.
Tigeciclina es lipofílica y con Vd elevado. Es improbable que la hemodilución inducida por la ECMO incremente el Vd. La dosis de carga clásica de 100 mg seguida 50 mg cada 12 horas es considerado suficiente. Sin embargo, en situaciones de riesgo de seleccionar microorganismos resistentes o con terapia renal añadida, algunos autores sugieren dosis de carga de 150 mg de carga, seguido de DM de 50 a 100 mg cada 12 horas.
Colistina. Es una gran molécula catiónica con un alto PM (1.750 Da), unida a la capa lipídica de las membranas celulares. Además, del gran Vd. del paciente crítico, esta sustancia se adsorbe en las membranas de diálisis durante la TDE y al ser un antibiótico concentración – dependiente y utilizarse en infecciones altamente resistentes, es necesario por tanto, administrar dosis de carga elevadas 9 millones, seguido de 4,5 millones cada 8 horas.
Antifúngicos:
Voriconazol es un triazol de amplio espectro de segunda generación, lipofílico y su actividad antifúngica es concentración – dependiente. Han sido descritos, secuestros en el circuito de ECMO superiores al 70%, por ello, durante los primeros días, la dosis de voriconazol debe ser incrementada a 6 mg/kg cada 12 horas, al menos durante las primeras 48 horas.
Cada vez que se recambie la membrana del oxigenador, debemos volver a utilizar durante 2 días, las dosis recomendadas previamente.
Dosis de mantenimiento a 4 mg/kg/12 horas
Es recomendable la monitorización de sus niveles y de la función hepática.
Fluconazol, hasta el 80% es reabsorbido a nivel tubular renal. La monitorización de la función renal es imperativa para evitar infradosificación. La dosis debe ser incrementada (igual que con la TDE) hasta 400-600 mg cada 12 horas con monitorización de niveles séricos y función hepática.
La dosificación de antibióticos y adaptación de la dosis en pacientes críticos en ECMO es como una mancha ciega. Actualmente, es conocido que algunos antibióticos y antifúngicos son secuestrados desde la circulación durante la ECMO. Los mecanismos de secuestro es multifactorial y difiere entre agentes lipofílicos e hidrofílicos. El impacto de la ECMO sobre la farmacocinética de los antimicrobianos es relevante porque una inadecuada cobertura antimicrobiana se asocia con fallo terapéutico y desarrollo de resistencia junto a un peor pronóstico. En analogía con el dialitrauma en la TDE, podemos acuñar un término para describir el daño colateral engendrado por la ECMO sobre el empleo de antimicrobianos, denominándolo “ECMO trauma”
NORMAS ESPECÍFICAS
| AMINOGLUCÓSIDOS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Recomendación) |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Amikacina | DC 15-25 mg/kg
DM: 7,5-15 mg/kg/24-48 horas Monitorizar niveles Intervalos de dosis extendido |
Administrar dosis de carga elevada por el mayor Vd. del paciente crítico y después, ajustar monitorizando sus niveles y aumentar intervalos de dosis (36 a 48 horas). | DC: 35 mg/kg
DM: Monitorizar niveles |
| Gentamicina | DC: 3 mg/kg
DM: 5-7 mg/kg/ 48 horas |
DC: Habituales
DM: Monitorizar niveles |
|
| Tobramicina | DC: 3 mg/kg
DM: 5 mg/kg/ 48 horas |
Lam S W et al. Amikacin Pharmacokinetics during continuous veno-venous hemodialysis. Infect Dis Ther 2013; 2: 217 – 26
De Rosa F et al. Amikacin dosing in the ICU: We know now more, but still not enough. Intensive Care Med 2014; 40: 1033 – 5
| CEFALOSPORINAS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Recomendación) |
ECMO |
| Cefazolina | CVVH: 1 gr – 2 gr / 12 h
CVVHD ó CVVHDF: 2 g cada 12 h iv |
1 gramo / 8 horas |
|
| Cefepima | CVVH: 1- 2 gr / 12 h
CVVHD ó CVVHDF: 1-2 g cada 12 h iv. Meningitis o Gram negativos con CMI > 4: 2gr / 8 h. |
2 gramos cada 8 horas | |
| Cefotaxima | CVVH: 1-2 g / 8-12 h.
CVVHD ó CVVHDF: 1-2 g/6 – 8 h. |
||
| Cefoxitina | 1-2 g cada 8-12 horas iv | ||
| Ceftarolina | 300 mg cada 8 – 12 horas | ||
| Ceftazidima
Ceftazidima + Avibactam |
1 g /8-12 horas iv
CMI > 4: 2 g de carga + 3 g/día pc CMI 8 mg/ml: Hasta 3 gr cada 8 horas |
||
| Ceftolozano + Tazobactam | 1,5 gr (1 gr de Ceftolozano + 500 mg de Tazobactam cada 8 horas) | ||
| Ceftriaxona | 1-2 g/12 – 24 horas iv | ||
| Cefuroxima | 1500 mg de dosis de carga
750 mg /12 horas iv |
Koedijk J B et al. Pharmacokinetics of cefotaxime in critically ill patients with acute kidney injury treated with 2 continuous renal replacement therapy: a pilot study. Antimicrob. Agents Chemother 2016; 60: 3587-90
Gao C et al. Pharmacokinetics of cefoperazone/sulbactam in critically ill patients receiving continuous venovenous hemofiltration. Eur J Clin Pharmacol 2016;72;823-30.
| CARBAPENEMS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Recomendación) |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Ertapenem | 1 gramo cada 24 horas iv | ||
| Imipenem | CVVH: 250 mg / 6 h ó 500 mg/6-8 h
CVVHD ó CVVHDF: 500 mg/ 6-8 h. Evitar por alto riesgo de convulsiones |
La farmacocinética de la cilastina dificulta su empleo | Alta variabilidad. Se recomienda 4 gramos al día |
| Meropenem |
DC de 2 gramos DM: 1 gr cada 8 – 12 horas |
Es el carbapeneme de elección en el paciente con CRRT. Ajustar según niveles e infusión prolongada. | DC: 2 gramos
DM: 1-2 g en 3 h/ 8 h dependiendo si la CMI es < ó > de 2 |
Cotton A. et al. Using Imipenen and cilastin during continuous renal replacement therapy. Pharm World Sci 2005; 27: 371 – 5.
Arantxazu I. y cols. Population pharmacokinetics of Meropenem in critically ill patients undergoing continuous renal replacement therapy. Clin Pharmacokinet 2008; 47: 173 – 180.
| GLUCOPÉPTIDOS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Teicoplanina | 100-300 mg al día | DC: 15 mg/kg tres veces /12 horas
DM: 600 mg al día Suplementar de forma “generosa” a la dosis calculada por su buen perfil de seguridad. |
Infecciones leves-moderadas: (DC) 600 mg y (DM) de 400 mg en pacientes con ECMO sin TDE.
DC de 800 mg y una DM 600 mg para aquellos con TDE. Infecciones graves: DC de1000 mg y DM de 800 mg para pacientes con ECMO sin TDE. Y una DC 1200 mg y DM 1000 mg para pacientes con ECMO + TDE. |
| Vancomicina | DC: 1,5 gramos
DM: Ajustar dosis para Cmin entre 15 y 20 mg/L |
DC: 35 mg/kg en 4 h
DM 14 mg/kg/día en pc DM: Monitorizar NIVELES |
DC: 30 mg/kg en 4 h
DM: 30-40 mg/kg/día Monitorizar NIVELES |
Como ocurre con la mayor parte de los antibióticos hidrofílicos, la estandarización de la dosis no logra habitualmente los objetivos farmacocinéticos y farmacodinámicos. Es recomendable una dosis de carga «generosa» de vancomicina, seguido de unas dosis de mantenimiento guiadas si es posible por monitorización sérica por la gran variabilidad en la vida media en los pacientes con disfunción renal.
Mayores dosis de vancomicina pueden ser requeridas en pacientes críticos con altos flujos de efluentes en la técnica continua y/ó presencia de patógenos poco susceptibles.
Teicoplanina tiene una alta unión a proteínas, dificultando su dosificación en enfermos críticos con hipoalbuminemia con alto aclaramiento de la fracción no unida a proteína; es aconsejable suplementar “generosamente” la dosis a la calculada por su buen perfil de seguridad.
*Honoré PM et al. Applying pharmacokinetic/pharmacodynamic principles for optimizing antimicrobial therapy during continuous renal replacement therapy. Anaesthesiology Intensive Therapy 2017,49, 412–8.
Beumier M, Roberts JA, Kabtouri H, et al. A new regimen for continuous infusion of vancomycin during continuous renal replacement therapy. J Antimicrob Chemother 2013; 68:2859–2865
Jin W et al. Population Pharmacokinetics and Dose Optimization of Teicoplanin during Venoarterial Extracorporeal Membrane Oxygenation. Antimicrob. Agents Chemother 2017;61.
| MACRÓLIDOS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO |
| Azitromicina | 500 mg / día iv/vo | Sin cambios (no se dializa) | 500 mg cada 24 horas |
| Claritromicina | 500 mg /12 – 24 h vo/iv | ||
| Eritromicina | Sin cambios |
| PENICILINAS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Amoxicilina | 500 mg iv cada 12/ h. | Mayores dosis en las primeras 48 horas en sepsis grave o shock séptico y si es posible, usar infusión extendida. | |
| Amoxicilina- clavulánico | 500/125 mg cada 12 horas | ||
| Ampicilina | CVVH: 1-2 g/8 – 12 h iv y
CVVHD o CVVHDF: 1-2 g/6 – 8 h |
||
| Ampicilina-sulbactam | CVVH: 3 gramos cada 12 horas iv
CVVHD o CVVHDF: 3 g cada 8 h iv |
||
| Cloxacilina | 0,5 – 1 g / 4 – 6 h vo
1-2 gramos / 4 – 6 h iv |
||
| Oxacilina | 2 gramos cada 4 – 6 horas | ||
| Penicilina G
Bencilpenicilina |
2 – 4 millones cada 6 horas
CVVH: DC: 4 millones. DM: 2 millones cada 6 horas iv CVVHD: DC: 4 millones. DM: 2-3 millones cada 6 horas iv. CVVHDF: DC: 4 millones. DM: 2-4 millones cada 6 horas iv. |
||
| Piperacilina-tazobactam | DC: 4,5 gramos
DM: 16/2 gr en infusión contínua
|
DC: 4 gramos
DM: 16 g (pc) al día |
Shotwell M S et al. Pharmacokinetics and Pharmacodynamics of Extended Infusion Versus Short Infusion Piperacillin-Tazobactam in Critically Ill Patients Undergoing CRRT. Clin J Am Soc Nephrol 2016; 11; 1377-83
Se recomiendan mayores dosis en las primeras horas (24-48 horas) en los casos de sepsis grave o shock séptico y si es viable, emplear infusiones extendidas para mantener concentraciones séricas adecuadas durante los intervalos de dosis. Los ensayos clínicos no han demostrado beneficios significativos de mortalidad.
Seyler L, Cotton F, Taccone FS, et al. Recommended b-lactam regimens are inadequate in septic patients treated with continuous renal replacement therapy. Crit Care 2011; 15:R137. An original research article with intensive pharmacokinetic sampling on multiple days of therapy that shows that dosing during the initial 24–48 h of therapy in critically ill patients receiving CRRT is commonly subtherapeutic. A description of the need for higher doses during this initial phase of therapy is provided.
La estandarización de las dosis no es posible con los datos disponibles en la actualidad
Roberts DM, Roberts JA, Roberts MS, et al. Variability of antibiotic concentrations in critically ill patients receiving continuous renal replacement therapy: a multicentre pharmacokinetic study. Crit Care Med 2012;40: 1523–8. A multicentre pharmacokinetic study highlighting the pharmacokinetic variability ofb-lactam, glycopeptide and fluoroquinolone antibiotics in the presence of similar RRT regimens.
| QUINOLONAS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Ciprofloxacino | DC: 800 mg
DM: 400 mg / 8 – 12 h iv |
DC: 800 mg
DM: 400 mg / 8 h ó 600 mg/12 horas |
|
| Levofloxacino | CVVH: 500-750 mg y DM 250 mg/24 h
CVVHD: 500-750 mg y DM 250 – 500 mg/24 h CVVHDF: 500-750 mg y DM 250-750 mg/24 h |
Dosis habituales | |
| Moxifloxacino | 400 mg cada día |
Roger C et al. Comparison of equal doses of continuous venovenous haemofiltration and haemodiafiltration on ciprofloxacin population pharmacokinetics in critically ill patients. J Antimicrob Chemother 2016;71: 1643-50
Sinnah F et al. Incremental research approach to describing the pharmacokinetics of ciprofl oxacin during extracorporeal membrane oxygenation. Crit Care Resusc 2017; 19: 8-14
| OTROS | CRRT (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Aztreonam | CVVH: 1 gr – 2 gr / 12 h
CVVHD o CVVHDF: 2 g cada 12 h iv |
||
| Clindamicina | 600 mg iv cada 6 a 8 h | 900 mg cada 6 horas | |
| Cloranfenicol | 1 gramo cada 6 horas | ||
| Cloroquina | 100 a 125 mg cada día | ||
| Colistina | 3 millones cada día
|
CVVH: DC 9 millones y DM 4,5 millones cada 12 horas
CVVHDF: DC 9 a 12 millones y DM 6.7-7,5 millones / 12 h. |
DC: 9 millones
DM: 4,5 millones / 8 h |
| Cotrimoxazol | CVVH: 2,5 – 7,5 mg/kg/12 horas
CVVHD o CVVHDF: 4 – 5 mg/kg/6 – 8 h. Neumonía P Jiroveci 10 mg/kg/12 h iv |
DC: 1200 mg/240mg
DM: 800 mg/160 mg/8 h |
Dosis habituales |
| Daptomicina | 8-10 mg/kg/48 h.
|
DC: 8 mg/kg.
DM: Ajustar según tasas de aclaramiento |
|
| Doxiciclina | 100 mg cada 12 horas | ||
| Etambutol | 15-25 mg/kg/24 – 36 h | Aumenta dosis habituales en un 50% | |
| Fidaxomicina | Sin cambios | ||
| Foscarnet | 60 mg/kg/día | ||
| Fosfomicina | 2 – 6 gramos / día iv
CVVH: 8 g / 12 h |
||
| Linezolid | 600 mg cada 12 horas
HF alto volumen: 600 mg / 8 horas |
DC: 600 mg en 60 min
DM: 600 mg/ 12 h ó 1200 mg en infusión continua |
CMI <1 mg/ml: 600 mg /12 h CMI >1 mg/ml: DC de 600 mg + DM de 1200 mg en pc
Monitorizar Niveles |
| Metronidazol | 500 mg cada 6 – 8 horas iv | ||
| Rifampicina | 300 – 600 mg cada 12 – 24 horas | 20 mg/kg cada día | |
| Tigeciclina | 50-100 mg cada 12 horas | DC: 150 mg
DM: 50 -100 mg / 12 h. |
DC: 100 mg
ECMO+TDE: 150 mg DM: 50 mg / 12 h. ECMO+TDE: 50-100mg/12 h |
Markou N et al. Colistin pharmacokinetics in intensive care unit patients on continuous venovenous haemodiafiltration: an observational study. J Antimicrob Chemother 2012; 67: 2459 – 2462.
Fiaccadori E et al. Colistin Use in Patients With Reduced Kidney Function. Am J Kidney Dis 2016;68:296-306.
Karaiskos I et al. Challenge for higher colistin dosage in critically ill patients receiving continuous venovenous haemodiafiltration. International J of Antimicrobial Agents 2016; 48, 337–341
Honore PM et al. Colistin Dosing in Continuous Renal Replacement Therapy. Annual Update in Intensive Care and Emergency Medicine, 2018. 71-6
Mary Vilay A et al. Daptomycin pharmacokinetics in critically ill patients receiving continuous venovenous hemodialysis. Crit Care Med 2011; 39: 19 – 25.
Wenisch JM, Meyer B, Fuhrmann V, et al. Multiple-dose pharmacokinetics of daptomycin during continuous venovenous haemodiafiltration. J Antimicrob Chemother 2012; 67:977–983. An original research study describing the pharmacokinetic of daptomycin during multiple doses in critically ill patients receiving CVVHDF. As a renal eliminated highly protein bound drug, it was found that accumulation.
Xu X et al. Population pharmacokinetics of daptomycin in adult patients undergoing continuous renal replacement therapy. Br J Clin Pharmacol. 2017; 83:498-509
Villa G et al. Effects of continuous renal replacement therapy on linezolid pharmacokinetic/ pharmacodynamics: a systematic review. Critical Care 2016; 20:374.
Honore PM et al. The blind spot in high-dose tigecycline pharmacokinetics in critically ill patients: membrane adsorption during continuous extracorporeal treatment. Critical Care 2015, 19:24
| ANTIFÚNGICOS | CRRT (Mensa 2018)
(Golightly LK 2013)
|
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Anfotericina B complejo lipídico y liposomal | 3-5 mg/kg/día | 3 mg/kg/día | |
| Anidulafungina | DC: de 200 mg/día en 3 h.
DM: 100 mg/día en 90 min. |
Dosis habituales | |
| Caspofungina | DC: 70 mg /día
DM: 50 mg /día |
70 mg al día | |
| Flucitosina | 25 mg/kg/ 12 horas iv | ||
| Fluconazol | CVVH: 200 – 800 mg/ día
CVVHD o CVVHDF: 400 – 800 mg/ día |
400-600 mg / 12 horas | DM: 400-600 mg /12 h. |
| Itraconazol | 200 mg / 12 h (2 días) +
200 mg/ día iv |
||
| Ketoconazol | 200 mg al día | ||
| Micafungina | 100 mg al día | 100 mg al día | |
| Voriconazol | DC: 6 mg/kg
DM: 4 mg/kg/12 horas vo (Golightly LK 2013) DC: 400 mg / 12 h vo ó 6 mg/kg iv DM: 200 mg / 12 h vo ó 4 mg/kg/12 h iv |
DC: 6-8 mg(kg
DM: 4-6 mg/kg/12 horas Monitorizar niveles |
DC: 6 mg/kg / 12 h x 48 horas
Si recambio de membrana volver a emplear la DC DM 4 mg/kg/12 horas Monitorizar niveles |
La conducta farmacocinética de los antifúngicos durante la TDE en pacientes críticos está muy poco fundada. La eliminación es muy diferente de un compuesto a otro.
Fluconazol. Requiere dosis más elevadas de lo habitual durante la TDE. Es reabsorbido en los túbulos renales y al no existir reabsorción en el túbulo en situación de TDE, se aumenta su eliminación (si dosificáramos por aclaramiento de creatinina resultaría en una infradosificación peligrosa del fármaco). Su alta tasa de eliminación requiere dosis elevadas (hasta 600 mg cada 12 horas) pero debemos evaluar la posible toxicidad hepática o interacciones farmacológica que puede conllevar el empleo de estas dosis.
Las formulaciones lipídicas de Anfotericina no son afectadas por la terapia renal a dosis convencionales por lo que se aconseja administrarla a 5 mg/kg/día
Debemos tener en cuenta que en ocasiones, nos quedamos con concentraciones plasmáticas bajas de Voriconazol cuando se emplean las dosis recomendadas.
Caspofungina no se asocia con ninguna pérdida en el ultrafiltrado de la TDE
Hay escasez de datos disponibles de Anidulafungina y Micafungina pero si hay constancia de la escasa pérdida de estas drogas durante la TDE, por lo que las dosis clásicamente recomendadas son consideradas adecuadas.
Honoré PM et al. Use of antifungal drugs during continuous hemofiltration therapies. Annual Update in Intensive Care and Emergency Medicine 2012. Springer Verlag. Vincent JL.
Álvarez Lerma F y cols. Experiencia de Micafungina en pacientes con técnicas de depuración extrarrenal. Rev Esp Quimioter 2010;23: 184 – 18
| ANTIVIRALES | CRRT. (Mensa 2018)
(Golightly LK 2013) |
TDE
(Otras recomendaciones)* |
ECMO
Dosis de carga (DC) Dosis mantenimiento (DM) |
| Aciclovir | 600 – 1200 mg/24 horas vo
7,5-10 mg/kg/día iv Meningoencefalitis y VHZ 10 mg/kg/12 h iv |
||
| Adefovir | ND. Intentar evitar y si es necesario
10 mg vo / 48–72 h y monitorizar |
||
| Amantadina | 200 mg / semana | ||
| Ganciclovir | CVVH: 2,5 mg/kg/día
CVVHD o CVVHDF: 2,5 mg/kg/12 h DM: 2,5 mg/kg/día |
Dosis habituales | |
| Lamivudina | 50 mg al día
(Golightly LK 2013) 150 mg al día |
||
| Oseltamivir | 30-75 mg al día
(Golightly LK 2013) 75 mg cada 12 horas |
ND Tiene coeficiente de cribado de 1 | Dosis habituales |
| Ribavirina | 400 – 600 mg cada 12 horas | ||
| Valaciclovir | ND. No aplicable 500 mg al día | ||
| Valganciclovir | 450 mg cada 48 h vo | Considerar Ganciclovir iv | |
| Zanamivir | Sin cambios | ||
| Zidovudina | 100 mg cada 8 horas |
